اسید سولفوریک یک اسید معدنی است که به¬ طور طبیعی در گازهای خارج شده از آتشفشان وجود دارد و از عناصر گوگرد، اکسیژن و هیدروژن با فرمول مولکولی H۲SO۴ تشکیل شده است. اسید سولفوریک با نام های مختلف جوهر گوگرد، اسید باتری، سولفات هیدروژن، اسید سولفین، روغن ویتریول و سولفوریک نیز شناخته می شود. مایعی است روغنی، بی رنگ، بی بو و چسبناک که با آزاد شدن گرما در آب قابل اختلاط است. اسید سولفوریک، خورندگی بالایی دارد. این ترکیب در اثر تماس با چوب و بیشتر مواد آلی باعث خوردگی آنها می شود.
اسید سولفوریک در گذشته با نام جوهر گوگرد شناخته می شد و با هر درصدی در آب حل می شود. این ماده دارای مولکول های قطبی است که می توانند با یکدیگر پیوند هیدروژنی برقرار کنند. نقطه انجماد اسید سولفوریک ۳۷/۱۰ درجه سانتیگراد و دمای جوش ان ۳۳۷درجه سانتیگراد است. بنابراین در مناطق سرد سیر جهت تخلیه کامل مخزن از حرارات برای تخلیه تانکر و مخازن اسید استفاده می کنند. اسید سولفوریک با فلزات واکنش می دهد و با افزایش دما میزان این واکنش بیشتر خواهد شد، اما بر روی جیوه و سرب تاثیری ندارد.
اسید سولفوریک در لیست مواد خطرناک قرار گرفته است. این اسید یکی از اسیدهای معدنی قوی در کنار اسید کلریدریک و نیتریک است. ماده اکسیدکننده قوی است و در دماهای بالا با بسیاری از فلزات، کربن، گوگرد و سایر مواد نیز واکنش نشان می دهد. واکنش آن با آب بسیار جالب است. آب دانسیته کمتری نسبت به اسید دارد که سبب شده است اسید تمایل داشته باشد زیر آب قرار گیرد؛ اما ترکیب آنها به شدت گرمازا است به صورتی که آب داغ شده و به اطراف پاشیده می شود.
همانطور که می دانید pH اسیدها زیر ۷ و ph بازها بالای ۷ است. از این اسید می توان برای از بردن خاصیت قلیایی محلول ها استفاده کرد، زیرا به راحتی Ph را تغییر می دهد. PH این اسید ۲.۷۵ است. حجم تولید اسید سولفوریک در جهان به قدری بالا است که معمولاً از آن به عنوان «سلطان مواد شیمیایی» یاد می شود. در حقیقت این اسید به قدری با اهمیت است که سرانه مصرف آن به ازای هر فرد، یکی از شاخص های تعیین پیشرفت فنی کشورها محسوب می شود.
روش های تولید
الف - تماس مستقیم با گوگرد
ب - در آزمایشگاه از واکنش گاز گوگرد دی اکسید با هیدروژن پراکسید (آب اکسیژنه).
ج - تولید سولفوریک اسید در آزمایشگاه با استفاده از الکترولیز محلول مس (ll)سولفات.
روش تماس مستقیم تولید اسید سولفوریک دارای چهار مرحله است:
الف) استخراج گوگرد
ب) تبدیل گوگرد (نود و نه درصد) به دی اکسید گوگرد
S + O۲ → SO۲
ج) تبدیل دی اکسید گوگرد به تری اکسید گوگرد
SO۲ + O۲ → SO۳
د) تبدیل تری اکسید گوگرد به اسید سولفوریک
SO۳ + H۲O → H۲SO۴
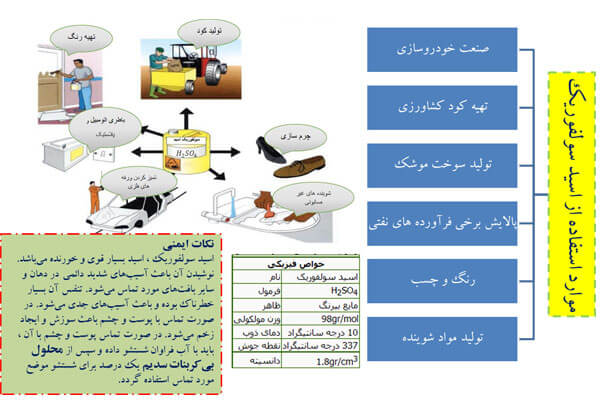
کاربردهای مهم اسید سولفوریک
کودهای شیمیایی: عمده ترین مصرف اسید سولفوریک درتولید کودهای شیمیایی سولفاته و فسفاته است(حدود ۶۰٪).
صنایع معدنی و فلزی: استخراج و تغلیظ سنگ معدن حاوی مس، روی یا سرب غالبا با استفاده از اسید سولفوریک انجام می گردد.
تولید باتری های اتومبیل و آب باتری: اسید سولفوریک به عنوان الکترولیت در باطری های اسیدی (سرب اسید) مورد استفاده قرار می گیرد. مورد مصرف این باتری ها در اتومبیل ها می باشد. اگرچه مقدار و غلظت اسید مورد نیاز برای هر باطری می تواند متفاوت باشد.
در صنعت چرمسازی برای زدودن چربی از چرم خام و در کارخانجات سالامبور سازی جهت خیساندن پوست و زدودن چربی
در صنعت نساجی برای تثبیت رنگ پارچه و نخ و خنثی سازی
در کارخانجات روغن نباتی جهت زدودن چربی از ماشین آلات
در برخی از واحدهای پودر و مایع شوینده جهت سولفوناسیون و تولید محلول چربی گیر و باز کننده لوله فاضلاب و شستشوی کاشی
در صنعت کاغذ جهت کنترل pH و تصفیه کاغذ و زدودن ناخالصی های معدنی
در صنعت تولید کلر در سلهای دیافراگمی جهت خشک کردن و آب گیری گاز کلر
ازاسید سولفوریک در تولید مواد منفجره مانند: نیتروگلیسیرین، TNT، RDX و PETN استفاده می شود. نیتروگلیسیرین ماده ای سمی است که اثرات تخریبی زیادی دارد؛ برای تولید نیتروگلیسیرین از اسیدهایی مانند اسید نیتریک و اسید سولفوریک استفاده می شود.
حمل و نقل اسید سولفوریک
در مکان خشک و خنک نگهداری شود و محل نگهداری بایستی به خوبی تهویه گردد. در گالن های پلی اتیلن و تانکر های از جنس فولاد و استیل ضد زنگ قابل حمل است.
ایمنی
جهت رقیق سازی باید اسید را به آب اضافه نمود. در صورت ریختن آب روی اسید به دلیل گرما زا بودن موجب پاشش آب و سوختن می گردد. در بروز آتش سوزی با کپسول CO۲ قابل خاموش شدن است. هنگام کار با اسید سولفوریک از لوازم حفاظت فردی شامل ماسک و لباس ضد اسید و دستکش و عینک استفاده گردد.
عوارض جانبی و خطرات اسید سولفوریک
اسید سولفوریک غلیظ بسیار خورنده است و در صورت عدم کنترل صحیح باعث سوختگی جدی می شود. این ماده شیمیایی نه تنها باعث سوختگی شیمیایی می شود، بلکه باعث سوختگی ثانویه حرارتی در نتیجه دهیدراته شدن بافت هم می شود. این ماده شیمیایی خطرناک در برخی موارد قادر به خورندگی پوست، کاغذ، فلزات و حتی سنگ است. اگر این ترکیب با چشم تماس مستقیم داشته باشد، می تواند باعث کوری دائمی شود. در صورت بلع، این ماده شیمیایی ممکن است باعث سوختگی داخلی، آسیب غیرقابل جبران عضو و احتمالاً مرگ شود. در صورت ریخته شدن اسید بر روی بدن سریعا لباس را از تن خارج کرده و محلول سوختگی را با آب فراوان، حداقل به مدت نیم ساعت شستشو دهید و از مالیدن هر نوع پماد یا کرم چرب یا هر داروی دیگری بدون تجویز پزشک خودداری کنید. از خنثی کردن اسید با قلیاها بپرهیزید زیرا گرمای ایجاد شده از عمل خنثی سازی باعث تشدید سوختگی محل می گردد.

اطلاعات آنالیز اسید سولفوریک و برگه اطلاعات ایمنی این محصول را می توانید از طریق لینک های زیر دانلود نمایید.
۱- دانلود آنالیز اسید سولفوریک
۲- دانلود یرگه اطلاعات ایمنی اسید سولفوریک
